El gen del cáncer MYC impulsa el crecimiento desenfrenado de la mayoría de los cánceres humanos. Se le ha llamado el «Monte Everest» de la investigación del cáncer debido a la dificultad de diseñar medicamentos que puedan desactivarlo y la expectativa de que un fármaco MYC eficaz pueda ayudar a tantos pacientes con cáncer. Grupos de investigación del Instituto Wertheim UF Scripps en Florida, el Instituto Max Planck de Fisiología Molecular en Dortmund y la Universidad de Münster han unido fuerzas y escalado ese pico mediante el desarrollo de compuestos inspirados en la naturaleza que cortan el ARN de MYC. Este enfoque innovador del degradador de ARN también podría abrir nuevas rutas para alcanzar otras enfermedades igualmente difíciles de tratar.
La forma en que las células cancerosas crecen, se dividen y se diseminan depende en gran medida de ciertas proteínas, lo que las convierte en un objetivo importante en la investigación y la terapia del cáncer. Sin embargo, la mayoría de las proteínas que impulsan el cáncer han eludido todos los intentos de los investigadores por detener sus efectos nocivos.
Dirigirse al ARN de los genes del cáncer ofrece una ruta alternativa para abordar estas enfermedades cuyas estructuras proteicas clave no pueden ser alcanzadas por los medicamentos. El ARN tiene muchas funciones: más allá de la plantilla de codificación de proteínas, regula la homeostasis en células sanas y cancerosas a través de interacciones críticas con una plétora de moléculas celulares. Sin embargo, las estructuras de los ARN son tan diversas y cambiantes que muchos en la industria farmacéutica descartaron tratar de hacer medicamentos dirigidos por ARN como un ejercicio sin sentido.
En el transcurso de 15 años, Matthew Disney y su grupo en The Wertheim UF Scripps Institute han logrado identificar muchas estructuras de ARN farmacológicamente conservadas. El equipo de Disney construyó sus propias colecciones de compuestos y mostró en ratones que atacar los ARN puede eliminar los tumores cancerosos y mejorar otras enfermedades, como la ELA y la distrofia miotónica. En 2016, durante una conferencia científica en España, cuando Disney y otro investigador compararon notas después de una charla, surgió por primera vez la idea de la asociación. Ambos estuvieron de acuerdo en que atacar el ARN con medicamentos presentaba una forma posible y emocionante de atacar enfermedades incurables, pero eran los primeros días. Nada de eso existía en el mercado.
En 2018, dos miembros del laboratorio de Disney visitaron el laboratorio de Waldmann en el Instituto Max Planck de Fisiología Molecular en Dortmund para usar sus métodos de detección y bibliotecas de compuestos que incluyen muchos compuestos inspirados en la naturaleza para buscar posibles candidatos de unión al ARN. Disney dijo que los resultados superaron sus expectativas: descubrieron que el universo de estructuras de ARN conocidas y farmacológicas se había expandido dramáticamente.
Algunos de los compuestos de la biblioteca fueron diseñados por el equipo del químico orgánico Frank Glorius de la Universidad de Münster. Los compuestos derivados del imidazol, una molécula común en productos naturales y medicamentos, modificados con cadenas basadas en carbono, finalmente demostraron ser los más efectivos para unirse a los ARN ligados al cáncer MYC, JUN y microARN-155.
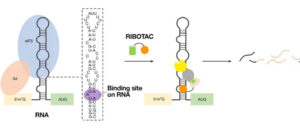
Sin embargo, la unión del ARN de estos objetivos solo no tuvo un impacto suficiente. Entonces, el equipo de Disney ideó un método innovador para editar estos segmentos de ARN que causan enfermedades. Lo hizo uniendo un anzuelo químico a las moléculas, uno diseñado para atrapar las enzimas de reciclaje de ARN de la célula. Funcionó según lo planeado. La enzima de reciclaje de ARN cortó el ARN al que estaba unida la molécula del fármaco, evitando que se construyeran las proteínas que causan enfermedades. Llamaron a su molécula híbrida RiboTAC, abreviatura de «quimera dirigida a la ribonucleasa».
MYC se encuentra entre los objetivos farmacológicos más importantes y desafiantes. Su activación puede afectar al 70 por ciento o más de todos los cánceres humanos. Puede ordenar que se construyan o silencien muchos otros genes. Afecta el crecimiento celular e incluso un programa de suicidio celular que lleva a las células dañadas a la autodestrucción, un proceso vital llamado apoptosis. También afecta el proceso de reparación del ADN dañado y el crecimiento de los vasos sanguíneos. En muchos cánceres, MYC se sobreexpresa, lo que hace que las células crezcan y se dividan demasiado rápido.
La activación de otro gen del cáncer, JUN, se ha observado en más de 20 tipos diferentes de cáncer, incluidos el glioblastoma, el de mama, el de próstata, el de pulmón, el colorrectal y más. Mientras tanto, un pequeño gen de ARN llamado MIR155 impulsa la inflamación y el crecimiento y la propagación de muchos tipos de cáncer. Los investigadores lo han encontrado activado en el cáncer de mama, riñón, gástrico y otros.